Umwälzungsfluss-Tests mit einem FlexGro® Biocontainer mit fest verbundenem Eintauchrohr für die Perfusionskultur

Einleitung
Perfusionsverfahren setzen sich schnell als alternative Methoden zu traditionellen Batch und Fed Batch Säugerzellkulturverfahren durch. In einem bestimmten Typ von Perfusionssystemen wird ein Bioreaktor an ein Rückzirkulationssystem angeschlossen, durch das verbrauchtes Medium gegen frisches ausgetauscht wird. Schaukel-Bioreaktoren, auch häufig als „Wave-Bioreaktoren“ bezeichnet, haben sich für Anwendungen in Arbeitsvolumina von unter 100 Litern bewährt, wie z.B. der Herstellung von Vorkulturen in der Säugerzellkultur und die Proteinproduktion im kleinen Maßstab. Die kontinuierliche Schaukelbewegung des Reaktors erzeugt eine Welle innerhalb des Einweg-Biocontainers, die die Belüftung der Zellkultur sicherstellt, ohne möglicherweise problematische, starke Scherkräfte zu erzeugen. Ein häufiges Problem bei der Nutzung von Schaukelreaktoren im Perfusionsmodus ist jedoch, dass unerwünschte Luftblasen in das Rückzirkulationssystem gelangen. Diese Luftblasen können sich dort festsetzen und die Effizienz des Perfusionsfilters beeinträchtigen. Üblicherweise werden hier Tangentialflussfiltrations- oder alternierende Tangentialflussfiltrations-Geräte verwendet. In diesem technischen Artikel wird untersucht, ob die Verwendung eines neuartigen fest verbundenen Eintauchrohrs in der Perfusionskultur verhindern kann, dass Luftblasen in das Rückzirkulationssystem gelangen. Ein FlexGro® Biocontainer mit 50 l Volumen wurde mit einer Rückzirkulationsschleife verbunden und unter verschiedenen Prozessbedingungen mit variierenden Flüssigkeitsvolumina, Schaukelfrequenzen und Schaukelwinkeln auf Lufteinschlüsse untersucht. Die erhaltenen Daten geben einen Einblick in das Verhältnis von Flüssigkeitsvolumen, Schaukelfrequenz und Schaukelwinkel, das wiederum hilfreich für die Definition eines nachgewiesenen akzeptablen Bereiches (proven acceptable range, PAR) der Perfusions-Prozessparameter ist.
Material und Methoden
Ein Meissner 50 Liter FlexGro® Biocontainer (Artikelnummer B12R00505-006), modifiziert mit einem fest verbundenen Eintauchrohr mit 1/4″ (6,35 mm) innerem und 7/16″ (11,11 mm) äußerem Durchmesser wurde auf einen Schaukel-Bioreaktor (GEHC, Wave Bioreactor 20/50 system) montiert und mit gefärbtem Wasser gefüllt. Dann wurde Luft bis zu einem Druck von knapp 70 mbar (1 psi) eingeleitet, wie in der Anleitung des Herstellers beschrieben. Ein Rückzirkulationssystem wurde etabliert, bestehend aus einem transparenten Silikonschlauch, der mit den Eingangs- und Ausgangsrohren verbunden wurde. Mit einer peristaltischen Pumpe (Masterflex® I/P) wurde eine konstante Rückzirkulations-Flussrate von 8 l/min aufrechterhalten. Abbildung 1 zeigt den experimentellen Aufbau. Schaukelwinkel von 6-10°, Schaukelfrequenzen von 15-35 rpm und Flüssigkeitsvolumina von 10-25 Litern wurden miteinander kombiniert um zu überprüfen, ob es zu einem Transfer von Luftblasen in das Rückzirkulationssystem kam. Tabelle 1 gibt einen Überblick über die Testparameter. Das Rückzirkulationssystem wurde einer Sichtprüfung unterzogen, um die Wanderung von Luftblasen unter den verschiedenen Testbedingungen zu untersuchen.

Ergebnisse und Diskussion
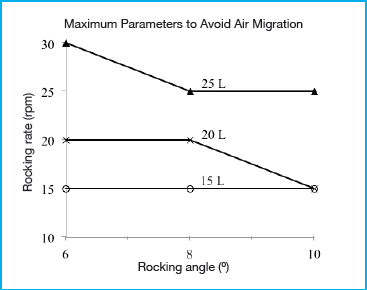
Die Grafik in Abbildung 2 zeigt die maximale Schaukelfrequenz, bestimmt als Funktion von Schaukelwinkel und Arbeitsvolumen, bevor Lufteinschlüsse zu beobachten waren. Eine Rückzirkulations-Flussrate von 8 l/min wurde verwendet, um worst case Bedingungen zu erzeugen und so die Wanderung von Luftblasen durch die Schläuche zu verstärken. Entsprechend der Hypothese hatten alle drei Faktoren: Schaukelwinkel, Schaukelfrequenz und Arbeitsvolumen einen Einfluss auf den Einschluss von Luftblasen in den Schläuchen. Eine Zunahme von Schaukelwinkel und Schaukelfrequenz, sowie ein verringertes Flüssigkeitsvolumen führten zu verstärktem Transfer von Luftblasen. Um Luftblaseneinschlüsse zu verhindern, scheinen zwei Faktoren wichtig zu sein. Zum einen muss das verbundene Eintauchrohr während der ganzen Zeit unterhalb der Flüssigkeitsoberfläche eingetaucht bleiben. Zum anderen darf die Flüssigkeit in der Nähe des Eintauchrohres keine Luftblasen enthalten. Alle drei Betriebsparameter: Volumen, Schaukelwinkel und Schaukelfrequenz, hatten einen Einfluss auf den ersten Faktor. Obwohl das verbundene Eintauchrohr an der Mittellinie des Biocontainers positioniert war, kam es unter bestimmten Bedingungen trotzdem zu Lufteinschlüssen, auch bei dem größten getesteten Arbeitsvolumen von 25 Litern. Wenn die Schaukelfrequenz hoch genug war (über 30 rpm bei einem Winkel von 8° oder mehr), führten die entstehenden Trägheitskräfte dazu, dass der Großteil der Welle unter die Mittellinie wanderte und die Flüssigkeitsoberfläche im Bereich unter der Öffnung des verbundenen Eintauchrohrs sank. Die Schaukelfrequenz ist der Parameter mit dem größten Einfluss auf den zweiten Faktor. Bei höheren Schaukelfrequenzen führt die stärkere Bewegung zu turbulenten Strömungsmustern, durch die Luftblasen in der Flüssigkeit entstehen. Es ist wahrscheinlich, dass dieser Effekt in einer Zellkultur durch die Entstehung von Schaum noch verstärkt wird. Es ist davon auszugehen, dass der verwendete 50 l Bioreaktor im Vergleich zu den kleineren 20 l und 10 l FlexGro® Bioreaktoren den worst case repräsentiert, da der Effekt der Trägheitskräfte auf die Entstehung von Mischturbulenzen bei kleineren Volumina vermutlich geringer ist.
Schlussfolgerung
Ein 50 l FlexGro® Biocontainer, modifiziert mit einem Mittellinien-Eintauchrohr zur Etablierung einer Rückzirkulationsschleife, ist für die Anwendung in Perfusionskulturen geeignet, vorausgesetzt, dass die verwendeten Betriebsparameter der Zellkultur innerhalb des nachgewiesenen akzeptablen Bereiches (PAR) bleiben, um Lufteinschlüsse zu verhindern. Weitere experimentelle Untersuchungen könnten notwendig sein, um einen normalen Betriebsbereich (normal operating range, NOR) für die genannten Betriebsparameter mit einer realen Zellkultur unter Perfusionskulturbedingungen zu ermitteln. Daher bieten die in diesem technischen Artikel gezeigten Ergebnisse nur erste Hinweise für den Einsatz von FlexGro® Biocontainern in der Perfusionskultur.
Für weitere Informationen oder Messdaten kontaktieren Sie bitte Meissner Filtration Products.