Essai de recirculation en utilisant un bioconteneur FlexGro® équipé d’un tube plongeur fixe pour les cultures en perfusion

Introduction
Les procédés en perfusions sont rapidement en train de devenir une alternative viable aux cultures discontinues (en « batch ») ou discontinues alimentées (en « fed-batch ») de cellules de mammifères. Dans un type de système de perfusion, un bioréacteur est connecté à une voie de recirculation où se produit le renouvellement du milieu de culture. Les bioréacteurs à bascule, également appelés bioréacteurs à vagues, ont été un choix populaire pour les applications de chaîne d’inoculation et la production de protéines à petite échelle pour des volumes de travail inférieurs à 100 litres. Le mouvement continu de bascule du bioréacteur produit une vague à l’intérieur du bioconteneur à usage unique, permettant ainsi au milieu de culture d’être oxygéné tout en éliminant les contraintes de cisaillement pouvant être problématiques. Toutefois, un défi est souvent rencontré lors de l’utilisation de bioréacteurs à bascule en perfusion : l’entrée non souhaitée d’air dans les voies de recirculation. Ces bulles d’air compromettent l’efficacité des filtres de perfusion, ces derniers reposant généralement sur des dispositifs de filtration à flux tangentiel (TFF) ou à flux tangentiel alterné (AFT). Dans ce rapport technique, nous évaluons une solution permettant de réaliser des cultures en perfusion par le biais d’un nouveau tube plongeur fixe conçu pour empêcher l’air de s’introduire dans la voie de recirculation. La présence d’air dans un bioconteneur FlexGro® de 50 l connecté à une boucle de recirculation a été évaluée dans différentes conditions de traitement, notamment différents volumes, fréquences de bascule et angles de bascule. Ces données expérimentales sont précieuses pour comprendre la relation entre volume de liquide, fréquence de bascule et angle de bascule. Ces informations sont cruciales afin de définir la fourchette acceptable prouvée (PAR) des paramètres pour un système de perfusion.
Matériel et méthodes
Un bioconteneur FlexGro® de 50 l (réf. B12R00505-006) modifié afin d’incorporer un tube plongeur fixe de 6,4 mm de diamètre interne et 11,1 mm de diamètre externe monté sur un bioréacteur à bascule (GEHC, Système Wave Bioreactor 20/50), rempli avec de l’eau colorée et gonflé avec de l’air jusqu’à atteindre une pression de 1 psi, selon les instructions du constructeur. Une voie de recirculation composée de tubes en silicone transparent est établie en connectant les tubes d’arrivée et de sortie. Une pompe péristaltique (Masterflex® I/P) est utilisée pour maintenir un débit de recirculation constant de 8 l/min. L’assemblage est détaillé dans la Figure 1. Des angles de basculement de 6 à 10°, des fréquences de basculement de 15 à 35 tr/min et des volumes de liquide de 10 à 25 l ont été utilisés conjointement pour déterminer une éventuelle entrée d’air dans le circuit de recirculation. Le tableau 1 résume les différents paramètres de test. La migration de bulles d’air dans le circuit de recirculation a été évaluée par inspection visuelle pour chacune des combinaisons testées.

Résultats et discussion
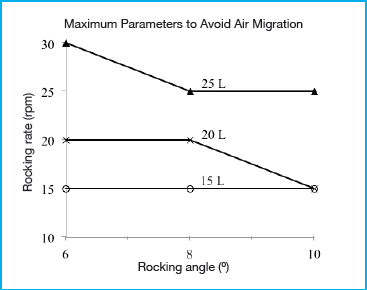
Le graphique présenté dans la Figure 2 montre la fréquence de basculement maximale, représentée en fonction de l’angle de basculement et du volume de travail avant que la migration de bulles d’air se produise. Un débit de recirculation de 8 l/min a été utilisé afin d’être représentatif des conditions de traitement les plus défavorables et pour amplifier la migration de bulles d’air dans le circuit. Conformément à l’hypothèse de départ, l’angle et la fréquence de basculement, ainsi que le volume de travail ont affecté le transfert de bulles d’air dans le circuit. L’augmentation de l’angle et de la fréquence de basculement contribue à augmenter le transfert de bulles d’air, tandis que des volumes de fluide plus faibles ont également entraîné une augmentation du transfert de bulles d’air. Afin d’empêcher la migration de bulles d’air, deux conditions semblent essentielles. Premièrement, le tube plongeur ancré doit à tout moment rester submergé sous le niveau du liquide. Deuxièmement, le liquide à proximité du tube plongeur ne doit pas contenir de bulles d’air. Les trois paramètres de fonctionnement, c’est-à-dire le volume, l’angle de basculement et la vitesse de basculement, contribuent à déterminer si la première condition est remplie. Bien que le tube plongeur ancré ait été positionné le long de la ligne centrale du bioconteneur, l’emprisonnement de bulles d’air se produit toujours dans certaines conditions, même lorsque le volume de travail le plus élevé est utilisé, soit 25l. Lorsque la vitesse de basculement est suffisamment élevée (supérieure à 30 rpm pour un angle supérieur ou égal à 8°), les forces d’inertie générées provoquent le déplacement de la majeure partie de la vague au-delà de la ligne centrale, ce qui fait baisser le niveau du liquide en dessous de l’entrée du tube plongeur ancré. La fréquence de basculement est le principal facteur qui contribue à ce que la deuxième condition soit remplie. À des fréquences de basculement plus élevées, l’agitation accrue entraîne des turbulences, lesquelles produisent des bulles d’air dans le liquide. Il est probable que cet effet soit exacerbé lors de cultures cellulaires réelles en raison de la production de mousse. Le bioconteneur de 50 L utilisé ici devrait être représentatif des conditions les plus défavorables par rapport aux petits bioconteneurs FlexGro® de 20 l et 10 l, car l’effet des forces d’inertie devraient alors générer moins de turbulences lors de l’agitation et du mélange.
Conclusion
Un bioconteneur FlexGro® de 50 litres modifié par un tube plongeur central afin de former une boucle de recirculation peut être utilisé dans des applications de perfusion, à condition que les conditions opérationnelles de culture utilisées restent dans les limites de la fourchette acceptable prouvée afin d’éviter tout emprisonnement d’air. Une évaluation expérimentale supplémentaire peut être nécessaire en conditions réelles de culture cellulaire afin de définir des paramètres opérationnels dans une plage de fonctionnement normal (NOR) adaptés à la culture en perfusion. Par conséquent, les résultats présentés dans ce rapport technique ne doivent servir que de guide initial vers l’adoption des bioconteneurs FlexGro® pour la culture en perfusion.
Pour plus d’informations ou de données issues d’analyses, veuillez contacter Meissner Filtration Products.