Test di ricircolo utilizzando un biocontenitore FlexGro® dotato di un tubo pescante fisso per coltura in perfusione

Introduzione
I metodi a perfusione si stanno adottando rapidamente come alternativa alle colture tradizionali in batch e fed-batch delle cellule di mammifero. In un particolare tipo di sistema a perfusione, un bioreattore è collegato a un sistema di ricircolo attraverso il quale avviene il rinnovo dei terreni di coltura. I bioreattori a piattaforma basculante, comunemente definiti anche bioreattori oscillanti, sono un’opzione diffusa per applicazioni con volumi di lavoro inferiori ai 100 L, come l’inoculo delle colture cellulari e la produzione di proteine su piccola scala. Il movimento oscillante del reattore genera un’onda all’interno del biocontenitore monouso, che consente l’insufflazione della coltura cellulare ed evita sforzi di taglio elevati che possono rivelarsi problematici. Tuttavia, un inconveniente comune quando si usano bioreattori basculanti in modalità di perfusione è l’ingresso indesiderato di bolle d’aria all’interno del sistema di ricircolo. Queste bolle d’aria intrappolate compromettono l’efficacia del filtro di perfusione, che normalmente si ottiene tramite un dispositivo di filtrazione a flusso tangenziale o a flusso tangenziale alternato. In questo documento tecnico viene analizzata una soluzione che permette la coltura in perfusione tramite un nuovo tubo pescante fisso concepito per impedire il passaggio di bolle d’aria nel sistema di ricircolo. Un biocontenitore FlexGro® da 50 L collegato a un circuito di ricircolo è stato testato allo scopo di rilevare la presenza di aria intrappolata in condizioni di lavorazione diverse per volume di liquido, frequenza di oscillazione e angolo di oscillazione. I dati sperimentali approfondiscono la relazione tra volume del liquido, frequenza di oscillazione e angolo di oscillazione, che è utile per definire l’intervallo operativo accettabile (PAR, cioè “proven acceptable range”) dei parametri di processo per il sistema a perfusione.
Materiali e metodi
Un biocontenitore FlexGro® Meissner da 50 L (articolo n. B12R00505-006) modificato per poter inserire un tubo pescante fisso da 6,35 mm x 11,11 mm (ID x OD) (¼” x 7/16″) è stato montato su bioreattore basculante (GEHC, sistema Wave Bioreactor 20/50), riempito con acqua colorata e gonfiato con aria a circa 70 mbar (1 psi), secondo le istruzioni del produttore. È stato quindi realizzato un sistema di ricircolo composto da un tubo in silicone trasparente collegato ai tubi di ingresso e di uscita. Per mantenere la portata di ricircolo costante a 8 L/min è stata utilizzata una pompa peristaltica (Masterflex® I/P). La preparazione del test è illustrata nella figura 1. Angoli di oscillazione tra 6° e 10°, frequenze di oscillazione tra 15 e 35 rpm e volumi di liquido tra 10 e 25 L sono stati utilizzati congiuntamente per stabilire se si verificava il trasferimento di bolle d’aria nel sistema di ricircolo. La tabella 1 riepiloga i parametri del test. Il sistema di ricircolo è stato sottoposto a un’ispezione visiva per individuare la migrazione di bolle d’aria nelle diverse condizioni operative in esame.

Risultati e discussione
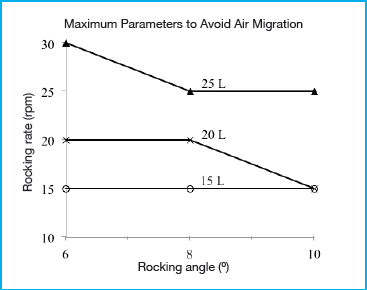
Il grafico presentato nella figura 2 mostra la massima frequenza di oscillazione determinata in funzione dell’angolo di oscillazione e del volume di lavoro prima della migrazione dell’aria. Per simulare le condizioni più sfavorevoli e amplificare la migrazione di aria attraverso il tubo è stata scelta una portata di ricircolo di 8 L/min. Come ipotizzato, l’angolo di oscillazione, la frequenza di oscillazione e il volume di lavoro hanno influito sul passaggio di aria nel tubo. Un aumento nell’angolo di oscillazione e nella frequenza di oscillazione e una riduzione nel volume del liquido hanno contribuito a incrementare il passaggio di aria. Per impedire la migrazione dell’aria sono sembrate essenziali due condizioni: innanzitutto, il tubo pescante fisso deve rimanere sempre sotto il livello del liquido; in secondo luogo, il liquido in prossimità del tubo pescante non deve contenere bolle d’acqua. I tre parametri di funzionamento –volume, angolo di oscillazione e frequenza di oscillazione – hanno contribuito a influenzare la prima condizione. Sebbene il tubo pescante fisso fosse posizionato lungo la linea centrale del biocontenitore, in certe condizioni si è comunque verificato un intrappolamento di bolle d’aria, perfino con il volume di lavoro più alto, ossia 25 L. Quando la frequenza di oscillazione si è innalzata abbastanza (oltre 30 rpm per un angolo di 8° o maggiore), le forze inerziali generate hanno provocato lo spostamento oltre la linea centrale della gran parte dell’onda, il che ha comportato un abbassamento del livello di liquido sotto l’apertura del tubo pescante fisso. Il principale fattore che permette di soddisfare la seconda condizione è la frequenza di oscillazione. Con frequenze di oscillazione superiori, è aumentata l’agitazione, che a sua volta ha prodotto andamenti turbolenti e quindi bolle d’aria nel liquido. È probabile che in una coltura cellulare questo effetto si aggravi ulteriormente in seguito alla formazione di schiuma. Si prevede che il biocontenitore da 50 L utilizzato rappresenti la condizione più sfavorevole rispetto ai biocontenitori FlexGro® più piccolo da 20 L e 10 L, perché si stima che l’effetto delle forze inerziali nel generare una miscelazione e un’agitazione turbolenta sia minore quando i volumi sono inferiori.
Conclusioni
Un biocontenitore FlexGro® da 50 L modificato con un tubo pescante per formare un circuito di ricircolo è adatto all’utilizzo nelle applicazioni di coltura in perfusione, purché le condizioni operative rientrino nel PAR per evitare l’intrappolamento dell’aria. Per determinare un intervallo operativo normale dei parametri di funzionamento adeguati alla coltura in perfusione, può essere necessaria un’ulteriore valutazione sperimentale in condizioni di coltura cellulare reali. Pertanto, i risultati presentati in questo documento tecnico servono solo come indicazione per l’adozione dei biocontenitori FlexGro® per la coltura in perfusione.
Per maggiori informazioni o per ricevere i dati del test, contatta Meissner Filtration Products.