Prueba de flujo de recirculación de un biocontenedor FlexGro®equipado con un tubo de inmersión anclado para cultivo de perfusión

Introducción
Los procesos de perfusión se están adoptando rápidamente como alternativa a los tradicionales cultivos por lotes y alimentados por lotes de células de mamíferos. En un tipo de sistema de perfusión, un biorreactor se conecta a una vía de recirculación donde se produce el intercambio de los medios gastados. Los biorreactores basculantes, también llamados frecuentemente biorreactores de onda, han sido una opción popular para aplicaciones de tren de semillas y producción de proteínas en pequeña escala para volúmenes de trabajo requeridos por debajo del rango de los 100 litros. El continuo movimiento de balanceo del reactor genera una onda dentro de un biocontenedor de un solo uso, lo que permite la aireación del cultivo celular y evita las situaciones problemáticas por alta cizalla. Sin embargo, un problema que se plantea frecuentemente al utilizar biorreactores basculantes en modo de perfusión es la transferencia indeseable de aire a la vía de recirculación. Estas burbujas de aire atrapadas comprometen la eficacia del filtro de perfusión, la cual se logra generalmente a través de un dispositivo de filtración de flujo tangencial (FFT) o de un dispositivo de filtración de flujo tangencial alterno (FTA). En este boletín técnico se evalúa una solución para permitir el cultivo de perfusión mediante un nuevo tubo de inmersión anclado que se ha diseñado para evitar la migración de aire hacia la vía de recirculación. Se sometió a pruebas un biocontenedor FlexGro® de 50 litros conectado a un bucle de recirculación para detectar la presencia de aire atrapado en condiciones de procesamiento variables de volumen de líquido, velocidad de oscilación y ángulo de oscilación. Los datos experimentales permiten comprender la relación entre el volumen de líquido, la velocidad de oscilación y el ángulo de oscilación, lo que resulta útil para definir el rango aceptable probado (RAP) de los parámetros de procesamiento del sistema de perfusión.
Material y métodos
Se montó un biocontenedor Meissner FlexGro®de 50 litros (número de pieza B12R00505-006) modificado para incorporar un tubo de inmersión anclado ¼» x 7/16″ (DI x DE) a un biorreactor basculante (GEHC, sistema de biorreactor de ondas 20/50), se llenó con agua teñida y se insufló aire a aproximadamente 1 psi, de acuerdo con las instrucciones del fabricante. Se estableció entonces una vía de flujo de recirculación compuesta por tubos de silicona transparente, interconectando los tubos de entrada y salida. Se utilizó una bomba peristáltica (Masterflex® I/P) para mantener un flujo de recirculación constante de 8 l/min. La configuración de la prueba se muestra en la Figura 1. Se utilizaron ángulos de oscilación de 6-10°, velocidades de oscilación de 15-35 rpm y volúmenes de líquido de 10-25 litros para determinar si se producía una transferencia de aire a la vía de recirculación. En la Tabla 1 se resumen los parámetros de las pruebas. Se inspeccionó visualmente la vía de recirculación para detectar la migración de burbujas de aire en cada una de las combinaciones operativas sometidas a prueba.

Resultados y discusión
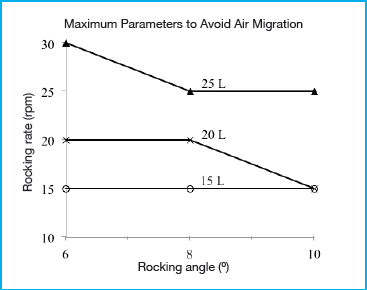
El gráfico que se presenta en la Figura 2 muestra la tasa de oscilación máxima determinada en función del ángulo de oscilación y el volumen de trabajo antes de que se produjera la migración del aire. Se utilizó un caudal de recirculación de 8 l/min para representar las condiciones límite admisibles y amplificar la migración del aire a través de los tubos. Según la hipótesis, el ángulo de oscilación, la velocidad de oscilación y el volumen de trabajo tuvieron un efecto sobre la transferencia de aire al tubo. El aumento del ángulo de oscilación y de la velocidad de oscilación contribuyó a aumentar la transferencia de aire, mientras que la disminución del volumen de los líquidos también dio lugar a un aumento de la transferencia de aire. Para evitar la migración de aire, el cumplimiento de dos condiciones parecía ser crucial. Primero, el tubo de inmersión anclado debe permanecer sumergido por debajo del nivel del líquido en todo momento. Segundo, el líquido cerca del tubo de inmersión no puede contener burbujas de aire. Los tres parámetros operativos de volumen, ángulo de oscilación y velocidad de oscilación contribuyeron a determinar si se cumplía la primera condición. Aunque el tubo de inmersión anclado se colocó a lo largo de la línea central del biocontenedor, todavía se produjo atrapamiento de aire bajo ciertas condiciones, incluso cuando se utilizó el volumen de trabajo más alto de 25 litros. Cuando la velocidad de oscilación se incrementó lo suficiente (por encima de 30 rpm para un ángulo de 8° o mayor) las fuerzas inerciales generadas hicieron que el grueso de la onda se moviera más allá de la línea central, dando como resultado un nivel de líquido situado por debajo de la abertura de entrada del tubo de inmersión anclado. El principal factor que contribuye a que se cumpla la segunda condición es la velocidad de oscilación. A mayores velocidades de oscilación, el aumento de la agitación dio lugar a patrones de flujo turbulentos, que produjeron burbujas de aire en el líquido. Es probable que este efecto se acentúe aún más durante el cultivo celular real debido a la generación de espuma. Se prevé que el biocontenedor de 50 l utilizado es representativo de condiciones límite admisibles en comparación con los biocontenedores FlexGro® de 20 l y 10 l más pequeños, porque se espera que el efecto de las fuerzas de inercia en la generación de mezcla y agitación turbulentas disminuya a volúmenes menores.
Conclusión
Un biocontenedor FlexGro® de 50 litros modificado con un tubo de inmersión de línea central para efectuar un bucle de recirculación apoya su uso en aplicaciones de perfusión, siempre que las condiciones de funcionamiento para cultivo utilizadas permanezcan dentro del RAP para evitar el atrapamiento de aire. Puede ser necesario realizar una evaluación experimental adicional utilizando las condiciones reales de los cultivos celulares para definir un rango operativo normal (RON) de los parámetros de funcionamiento adecuados para el cultivo de perfusión. Por lo tanto, los resultados presentados en este boletín técnico deben servir únicamente como guía inicial para la adopción de los biocontenedores FlexGro® para el cultivo de perfusión.
Para más información o datos de pruebas, contacte con Meissner Filtration Products.